研究テーマRESEARCH
微生物の進化実験を用いた適応進化ダイナミクスの解析
生物システムは、その環境変化に応じて柔軟に内部状態を変化させ、その環境に適応する能力を持ちます。例えば、大腸菌のような微生物を(これまでに経験のしたことがないような)一定のストレス環境下で長期間培養すると、 ゆるやかに増殖速度が上昇するといった適応進化の現象が見いだされます。これは、遺伝子ネットワークの応答反応のような表現型の変化と、ゲノム配列の変化、つまり遺伝子型の変化の双方が絡み合った現象である可能性が高いのですが、 その詳細は理解されていません。こうした生物システムの柔軟な環境適応を解析することは、複雑な細胞システムがどのように適応・進化をすることが出来るかといった生物学の本質的な問題を扱うと同時に、生物を用いた物質生産過程における生産性向上や、 生物的な柔軟性・安定性を持つ人工システムのデザインなど、工学的な応用においても重要な意味を持ちます。そこで私達は、大腸菌を用いて様々なストレス環境や抗生物質を添加した環境下での進化実験を行い、その過程における表現型と遺伝子型の網羅的解析を行っています。 例えば下図では、5%エタノール環境下で大腸菌を約1000世代培養したときの増殖速度の変化を示しています。 マイクロアレイを用いたトランスクリプトーム解析と、質量分析器を用いたメタボローム解析の結果は、独立に培養した系列の間で 共通の表現型の変化が生じたことを示しています。一方で、超並列シーケンサを用いたゲノム変異解析の結果は、この過程でゲノムに固定された変異は数個程度であり、 また系列間の共通性は低いことを示しています。これらの結果は、このエタノール耐性という表現型の獲得が、ゲノムの変異に依らない表現型のメモリー機構に起因していることを 強く示唆しています。こうした現象は、抗生物質を添加した環境下での進化実験においても観察されています。我々のグループでは、高度な網羅的解析手法と進化実験を組み合わせ、 さらには数理モデルによる解析を援用することにより、この生物システムが持つ柔軟な表現型の可塑性と安定性について、そのメカニズムの理解を目指しています。
詳しくは、以下の論文を参照してください。
Suzuki, Horinouchi, Furusawa, Nature Communications 2014
Horinouchi et al, BMC Evol. Biol. 2015
Kaneko, Furusawa, Yomo, Phys. Rev. X. 2015
Furusawa and Kaneko, Jour. Roy. Soc. Interface 2015
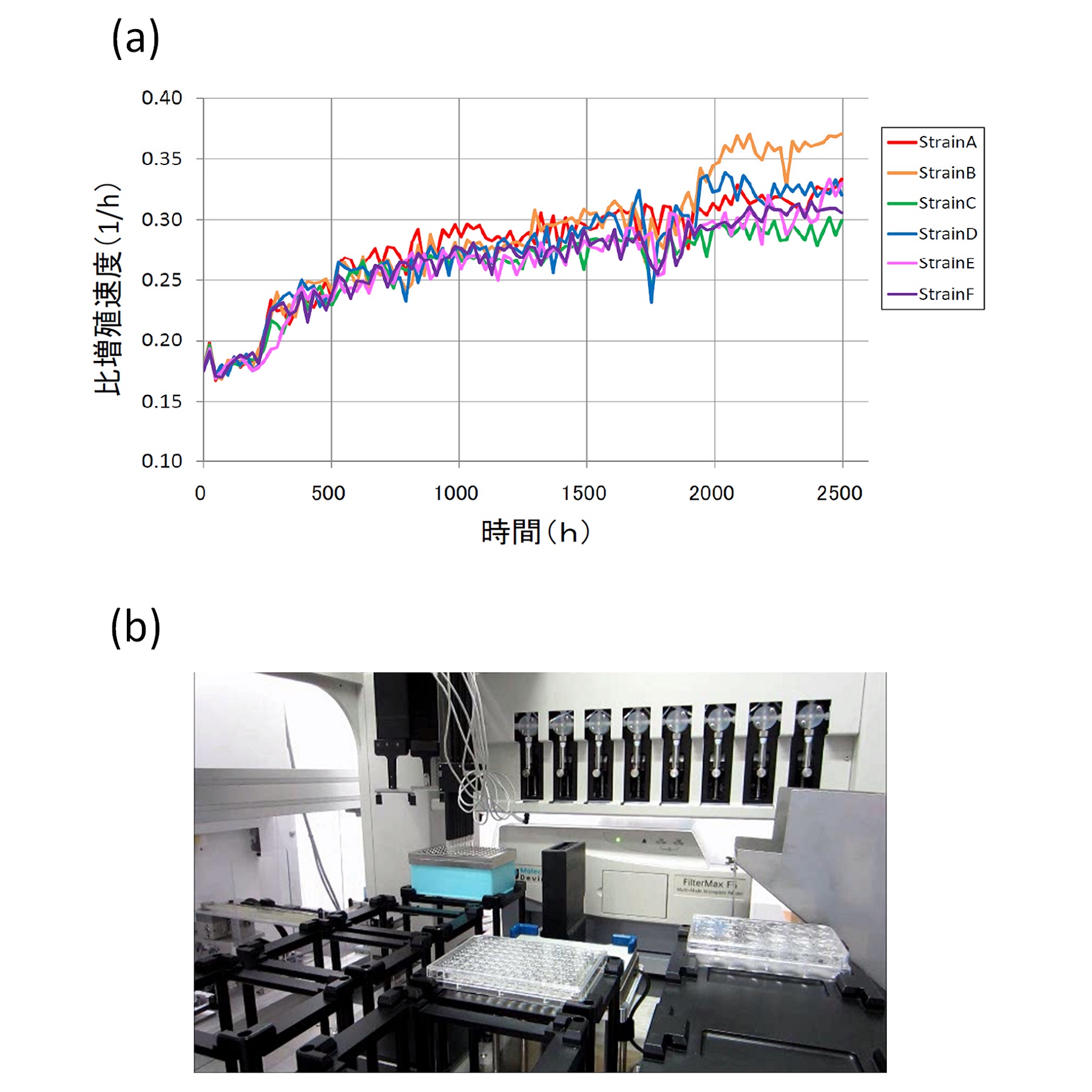
図(a):大腸菌の長期植え継ぎ培養結果の一例。この例では5%エタノール ストレス環境下において6つの独立系列の植え継ぎ培養を約1000世代(2500時間)行ったところ、 親株と比較して比増殖速度が有意に上昇したエタノール耐性株を取得することに成功している。図(b):ラボオートメーションによる全自動進化実験システムの外観。 クリーンブースに設置した分注機と、それに接続したプレートリーダー・インキュベータをコンピュータ制御することにより、 全自動で数百系列の植え継ぎ培養系列を維持することを可能とする。このシステムを用いて、様々な環境下での進化実験が進行している。
数理モデルを用いた多細胞生物の発生・分化過程の解析
多細胞生物の発生過程では、1つの受精卵が次々に分裂し、多様に異なるタイプの細胞へ分化することによって、複雑な体制を持つ個体が形成されます。
この過程を司る遺伝子やタンパク質などの構成要素は次々に同定されていますが、一方で、化学反応レベルでのゆらぎや、しばしば変動する環境下において、
どのようにこの発生過程が安定に進行するか、といった問題は不明な点が多く残されています。こうした問題は、細胞内外の構成要素を調べ上げるのみではなく、
それらの絡み合いによって生じるシステムとしての性質として理解すべきものだと考えられます。
そこで私達は、内部に化学反応や遺伝子制御のネットワークを持つ細胞が相互作用している簡単な多細胞モデルを計算機上に構築して、
そのシステムにおいて普遍的に見られる性質を調べています。ここで普遍的とは、モデルの細部に依存せずに出現することを意味しています。
その結果、多様な状態に分化する能力を持つ細胞(幹細胞と呼ばれています)は、時間的に複雑に振動する内部ダイナミクスを持ち、そこから分化してきた細胞は、
より単純な内部ダイナミクスを持つことが明らかになりました(下図を参照)。また、その複雑な内部ダイナミクスを幹細胞からの分化は、
周囲に存在する細胞の構成比によって勝手に制御され、結果として細胞集団レベルでの安定性を持つことが示されました。
この細胞シミュレーションの結果は、ES細胞や造血幹細胞、あるいは受精卵といった分化能を持つ細胞においては、複雑に振動する遺伝子発現のダイナミクスが
存在することを予言しています。実際に最近になって、幹細胞や分化能を持つ前駆細胞の内部状態が大きな多様性を持ち、
一部の遺伝子が時間的に振動していることが実験的に見いだされています。
私達は、こうした細胞シミュレーションからの帰結と、幹細胞の1細胞レベルでの実験的解析を組み合わせることにより、
細胞社会において自発的な細胞状態の「揺らぎ」がどのような役割を持つか、そのシステムとしての理解を目指しています。
詳しくは、以下の論文を参照してください。
Furusawa and Kaneko, Science 2012
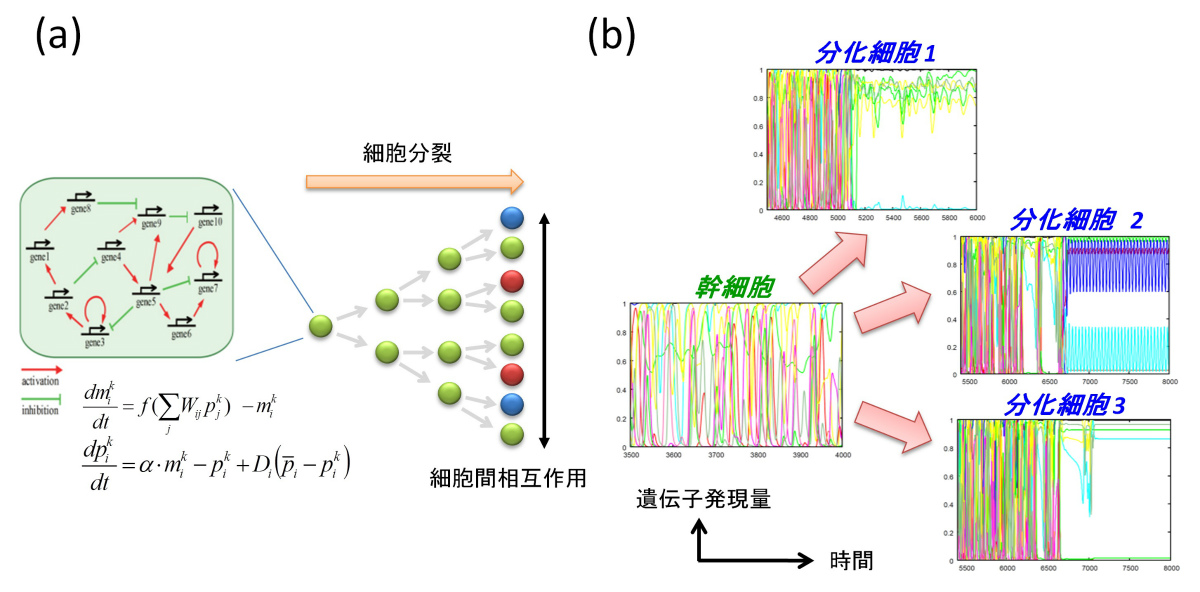
図(a): モデルの模式図。内部に遺伝子発現制御ネットワークを持つ細胞が、分裂をしつつ環境を通じて相互作用している。 図(b):相互作用による細胞分化過程の一例。それぞれの図は、複数の遺伝子発現量のダイナミクスを示している。細胞数が小さい場合には、 全ての細胞は図中の"幹細胞"とされた複雑に振動する細胞状態を持つが、分裂によって細胞数が増加することによって系全体が不安定となり、 一部の細胞が別のより単純なダイナミクスを持つ状態へ遷移する("分化細胞"の状態)。
数理モデルを用いた免疫システムの解析
免疫システムの本質的な役割は、システムの構成要素のうちどれが自己でどれが非自己であるかを識別し、非自己に対してのみ 適切な応答を示す点にあります。一般的には、抗体やT-Cell Receptor(TCR)を最初は多様な抗原に対して反応するように用意し、 胸腺などでの選択によって、自己に応答する免疫細胞が除かれる結果として、自己・非自己の識別は成り立っていると 説明されます。しかしながら、その選択の過程は必ずしも完全ではなく、自己に応答する免疫細胞も実際には生体内には存在し、 免疫細胞の自己・非自己の識別はかならずしも個々の細胞のonとoffのように単純な説明では実現が難しいものと予想されます。 そこで私達は、制御性T細胞(Treg)の働きに注目し、その働きによって個々の免疫細胞の応答性は自己と非自己を厳密に識別できなくても、 集団の振る舞いとして自己・非自己の識別が可能であることを数理モデルによって示しました。 こうした研究は、いい加減な免疫細胞の振る舞いから、頑強な免疫応答が出現する仕組みを説明することを可能とします。
細胞シミュレーションを用いた有用物質生産のための代謝デザイン
微生物を用いた有用物質生産は、バイオ燃料やプラスチックの原料などの生産が実用化されており、
環境負荷の小さい有用化合物生産として注目を集めています。一般に、有用物質を生産させるためには微生物の代謝ネットワークを
改変することが必要ですが、代謝ネットワークの複雑性から、どのような代謝改変が最適であるかを予測することは難しい問題として残されていました。
そこで我々は、計算機によるシミュレーションを用いて、有用物質の最適化のためにどのような代謝改変が最適であるかを、
膨大な数の可能な代謝改変から適切に抽出するアルゴリズムを構築しました。こうしたアルゴリズムによって、
環境負荷が小さい微生物による有用化合物生産について、その効率を大幅に向上させることが期待出来ます。
詳しくは、以下の論文を参照してください。
Ohno, Shimizu, and Furusawa, Bioinformatics 2013